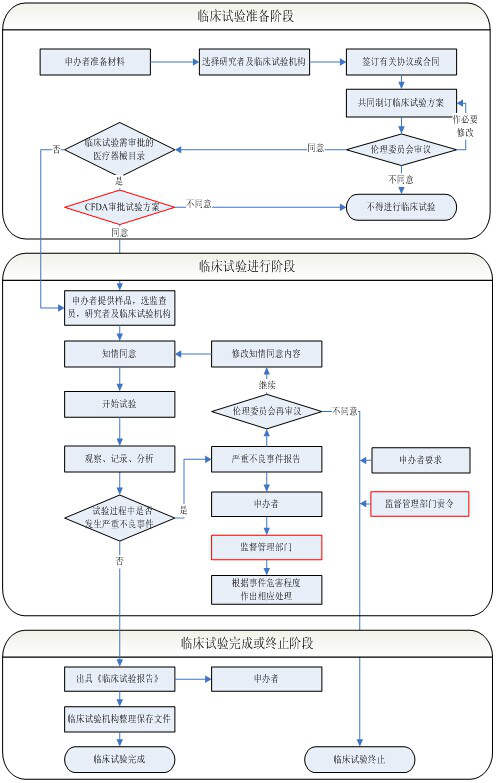
临床试验服务流程
1. 临床试验要求
根据《医疗器械监督管理条例》(国务院令第650号)的规定,第Ⅰ类医疗器械实行产品备案管理,不需要进行临床试验,但需要提交临床评价资料;第Ⅱ、Ⅲ类医疗器械注册时,应当进行临床试验(免于进行临床试验的第Ⅱ类医疗器械目录;免于进行临床试验的第Ⅲ类医疗器械目录的医疗器械除外);免于进行临床试验的医疗器械,在进行注册申报时,仍需提供临床评价资料。
2. 服务内容
a. 提供根据质量体系的要求生产临床试验样品,并经检测符合注册产品标准的要求的服务。
b. 提供临床试验基地的选择及联络接洽相关的服务。
c. 提供临床试验方案、CRF表起草及咨询的服务。
d. 提供临床试验批件提交、备案、不良事件报告等服务。
e. 提供整个临床试验跟踪直至取得报告的服务。
f. 为客户确定是否临床试验豁免,如不需要临床试验提供临床试验资料起草及制定的服务。
3. 服务流程